燃焼ガス量(排ガス量)の求め方について解説します。

- 燃料を燃やした時のガス量の求め方を知りたい!
- 出来れば計算例も見たい!
こんな人に向けた記事です。
こんにちは。
プラントエンジニアの火プライオンです。
この記事では、燃焼ガス量の求め方について解説します。
燃焼ガス量の求め方
燃焼ガス量は燃料の成分と燃焼空気量が分かれば計算することが出来ます。
以下に示す(1)~(4)を足し合わせることで求まります。
(2)燃焼反応で消費されなかった燃焼空気中の酸素と窒素(下図のピンク部分)
(3)燃料中の水分による水蒸気ガス(下図の青部分)
(4)燃焼空気に含まれる水分による水蒸気ガス(下図の緑部分)
(1)~(4)すべてを足し合わせたものを湿り燃焼ガス量、(1)の水素分の燃焼により発生する水蒸気以外のガス量と(2)を足し合わせたものを乾き燃焼ガス量と呼びます。
これを図にまとめると以下のようになります。
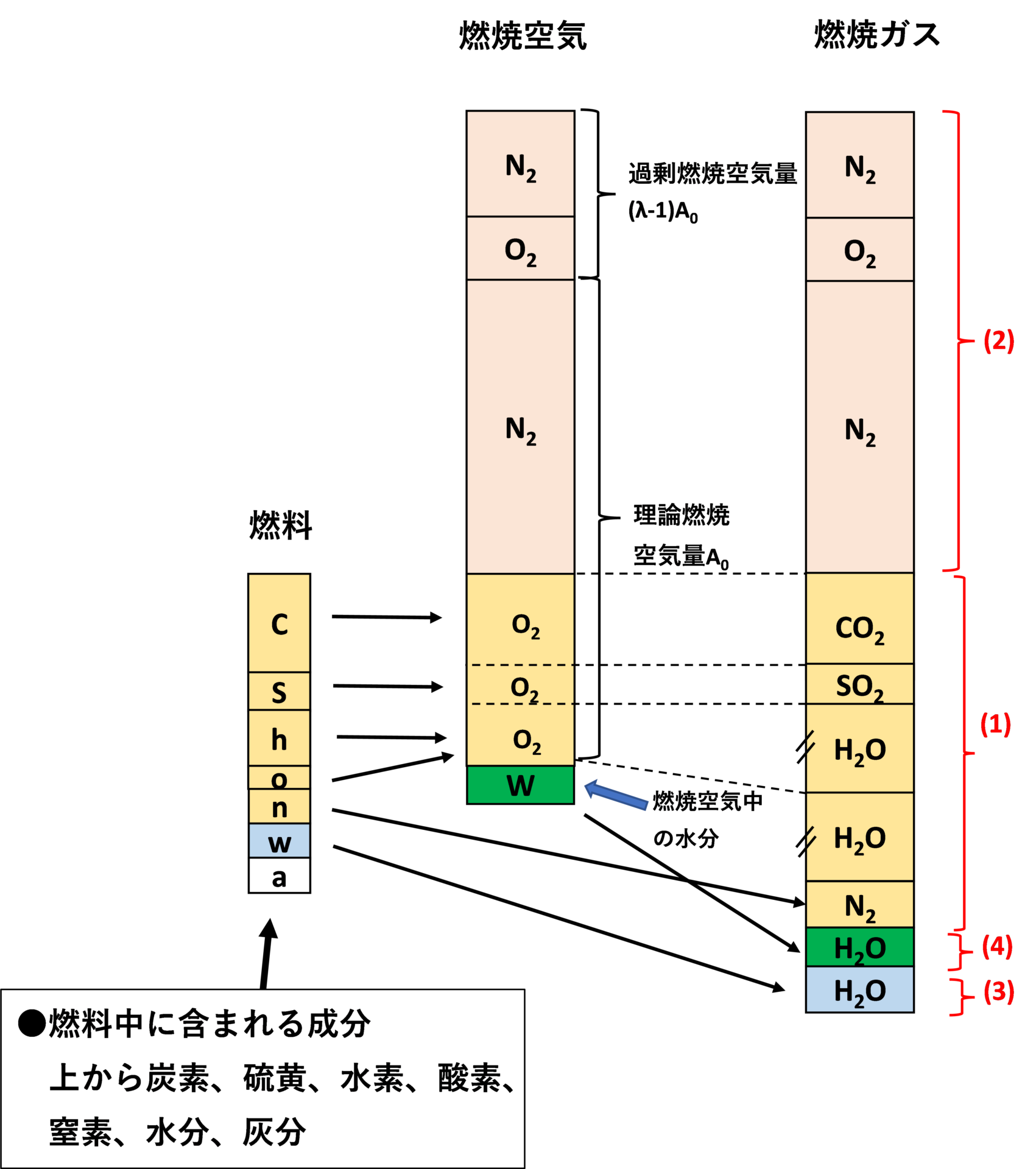
(1)燃料中の燃焼成分が酸化反応することにより発生するガス
燃料中には主に炭素C、硫黄S、水素H、酸素O、窒素N、水分w、灰分aが含まれています。
燃料の成分で酸化反応するのは、燃料中の炭素C、水素H、硫黄S分で、それぞれ熱を放出しながら二酸化炭素CO2、水蒸気H2O、二酸化硫黄SO2が生成され、燃焼空気中の酸素および燃料中の酸素が酸化反応により消費されます。
また、燃料中の窒素分は窒素ガスN2となります。
灰分は、燃焼灰となるのでここでは考慮しません。
(2)燃焼反応で消費されなかった燃焼空気中の酸素と窒素
(1)の酸化反応で消費されなかった燃焼空気中の酸素と空気中の窒素はそのまま燃焼ガスの成分となります。
(3)燃料中の水分による水蒸気ガス量(4)燃焼空気に含まれる水分
空気中や燃料中に含まれる水分も水蒸気となり燃焼ガスの一部となります。
以上を式で表すと以下のようになります。
(1)燃料中の燃焼成分が酸化反応することにより発生するガス量
$$\qquad V’_{(1)}= 22.4 (\frac{1}{12} C + \frac{1}{2}H + \frac{1}{32}S + \frac{1}{28}N)$$
C:燃料1kg中の炭素分 H:燃料1kg中の水素分 S:燃料1kg中の硫黄分
N:燃料1kg中の窒素分 [単位は全てkg/kg-fuel]
(2)燃焼反応で消費されなかった燃焼空気中の酸素と窒素
$$\qquad V’_{(2)}= 0.21(λ_a-1.0)Vao’ + 0.79λ_aVao’ $$
Vao’ [Nm3] : 理論燃焼空気 λa : 空気比
(3)燃料中の水分wによる水蒸気ガス
$$\qquad V’_{(3)}= \frac{22.4}{18} w$$
w [kg/kg-fuel]:燃料1kg中の水分
(4)燃焼空気中に含まれていた水分による水蒸気ガス
$$\qquad V’_{(4)}= λaZ’Vao’$$
Z’[Nm3/Nm3]:絶対湿度 λa:空気比 Vao’[Nm3] :理論燃焼空気量
それぞれについて見ていきましょう。
(1)燃料中の燃焼成分の酸化反応により発生するガス量
燃料の燃焼により発生するガス量Vg(1)は以下の式で求まります。
$$V’_{(1)}= 22.4 (\frac{1}{12} C + \frac{1}{2}H + \frac{1}{32}S + \frac{1}{28}N)$$
ここで、
C:燃料1kg中の炭素分 H:燃料1kg中の水素分 S:燃料1kg中の硫黄分
N:燃料1kg中の窒素分
燃料1kg中の各成分量が分かれば、燃料1kgの酸化反応による発生する燃焼ガス量を計算することが出来ます。
上式の導出について、それぞれの燃料中の成分について見ていきます。
【炭素】
炭素1molの燃焼後に発生する二酸化炭素分子は1molです。
炭素の原子量(1molあたりの質量)は12 g、二酸化炭素分子の1molあたりの体積は22.4 [ℓ]なので、炭素1molあたり
$$C (12[g])+O_2 (22.4[ℓ] ) = CO_2 (22.4[ℓ] ) $$
となります。
よって、炭素1g当たりの燃焼で発生する二酸化炭素量VCO2は、
$$V _{CO2} = \frac{22.4}{12} [ ℓ / g] $$
単位を1kgあたりに直して
$$V _{CO2} = \frac{22.4}{12} [Nm^3/kg]$$
1000ℓ = 1m3 1000g = 1kg
標準状態を表すNをm3の前に着けて
標準状態で22.4ℓ/g = 22.4Nm3/kg
となるよ!
【水素】
水素分子1molの燃焼により発生する水分子は1molです。
水素分子の1molあたりの質量は2gで、 発生する水分子の1molあたりの体積は22.4 ℓなので、水素分子1molあたり
$$H_2 (2[g])+\frac{1}{2}O_2 (11.2[ℓ] ) = H_2 O (22.4[ℓ] ) $$
となります。
よって、水素分子1g当たりの燃焼により発生する水VH2Oは
$$V _{H_2O} = \frac{22.4}{2} [ ℓ / g]$$
単位を1kgあたりに直して
$$V _{H_2O}= \frac{22.4}{2} [Nm^3/kg]$$
【硫黄】
硫黄1molの燃焼で発生する2酸化硫黄分子は1molです。
硫黄の原子量は32 [g]、2酸化硫黄分子の1molあたりの体積は22.4 ℓなので、硫黄1molあたり
$$S(32[g])+O_2 (22.4[ℓ] ) = SO_2 (22.4[ℓ] ) $$
硫黄1g当たりで発生する2酸化硫黄の量VSO2は、
$$V _{SO2} = \frac{22.4}{32} [ ℓ / g]$$
単位を1kgあたりに直して
$$V _{SO2}= \frac{22.4}{32} [Nm^3/kg]$$
【酸素】
燃料中の酸素は他の燃料の成分の酸化反応により消費されます。
このため、ガス量は燃料中の酸素量によらないのでここでは計算を行いません。
【窒素】
燃料中の窒素分は燃焼反応をするわけではないですが、燃料が燃焼すると窒素N2となります。
燃料中の窒素1molで燃焼で発生する窒素分子は0.5molです。
窒素の原子量は14 [g]、窒素分子の0.5molあたりの体積は11.2 ℓなので、窒素1molあたり
$$N(14[g]) = \frac{1}{2}N_2 (11.2[ℓ] ) $$
窒素1g当たりで発生する窒素ガス量VN2は、
$$V _{N2} = \frac{22.4}{28} = 0.7[ ℓ / g]$$
単位を1kgあたりに直して
$$V _{N2}= \frac{22.4}{28} [Nm^3/kg]$$
以上をまとめると
燃料中の成分によるガス量V‘(1)は、燃料1kgあたりの炭素、水素、硫黄の各重量[kg]をC, H , Sとして次のようになります。
$$V’_{(1)}= 22.4 (\frac{1}{12} C + \frac{1}{2}H + \frac{1}{32}S + \frac{1}{28}N)$$
(2)燃焼空気(燃焼に消費した酸素を除く)
燃料を燃焼するために投入した空気も燃焼ガス中に含まれます。ただし、燃焼反応によって空気中の酸素は燃焼に必要なだけ消費されるので、ここでは、燃焼反応によって消費されなかった燃焼空気量を考えます。
燃焼空気量の計算方法は別記事で解説していますのでこちらをご参照ください。
理論燃焼空気量の求め方を知りたい こんな人に向けた記事です。 こんにちは。 プラントエンジニアの火プライオンです。 この記事では、理論燃焼空気量の求め方について解説します。 発熱[…]
理論燃焼空気をVao’、空気比をλaとすると空気中に含まれる酸素量は21%のため、燃焼空気による燃焼ガス量V’(2)は次式で表されます。
$$V’_{(2)}= 0.21(λ_a-1.0)Vao’ + 0.79λ_aVao’$$
上式の右辺第1項は、空気の21%を占める酸素のうち(λ_a-1.0)倍だけボイラに余計に投入されて、燃焼に消費されなかった分だね!第2項は空気中の79%を占める窒素分などで燃焼反応では消費されないのでそのまま排ガスになるんだね。
(3)燃料中の水分wによる水蒸気ガス量
燃料には水分が含まれているものがあります。燃料中の水分は燃料の燃焼による熱で水蒸気として燃焼ガス中に含まれるので、下式で表現できます。
(水の分子量(1molあたりの質量)は 18[g]、水分子1molあたりの水蒸気の体積は22.4 ℓのため)
$$V’_{(3)} = \frac{22.4}{18} w$$
w [kg/kg-fuel]:燃料1kg中の水分
(4)燃焼空気に含まれる水分
空気中の水分も燃料の燃焼による熱で水蒸気として燃焼ガス中に含まれます。空気中の水分量は以下の式で計算できます。
$$V’_{(4)} = λaZ’Vao’$$
ここで
Z’:絶対湿度
λa:空気比
Vao’:理論燃焼空気量
以上V(1)~V(4)を足し合わせれば燃焼ガス量が求まります。
計算例!
では、重油を例に燃焼ガス量を求めてみましょう。
一般的な重油の成分は以下の通りです。
| 元素 | 重量パーセント[wt%] |
| C | 87.8 |
| H | 10.5 |
| S | 1.2 |
| O | 0.4 |
| N | 0.1 |
| w(水分) | 0 |
空気比1.2
理論燃焼空気量10.6Nm3/kg
大気温度25℃
相対湿度40%
として計算して行きましょう。
- 燃料中の成分により発生するガス量
$$V’_{(1)}= 22.4\times (\frac{1}{12} C + \frac{1}{2}H + \frac{1}{32}S + \frac{1}{28}N)$$
$$=22.4\times (\frac{1}{12} 0.878 + \frac{1}{2}0.105 + \frac{1}{32}0.012 + \frac{1}{28}0.001)$$
=2.82Nm3/kg
- 燃焼空気から燃焼に消費した酸素を取り除いたもの
$$V’_{(2)} = 0.21(λ_a-1.0)Vao’ + 0.79λ_aVao’ $$
$$=0.21 \times (1.2-1.0) \times 10.6+0.79 \times1.2 \times10.6$$
= 10.49 Nm3/kg
- 燃料中の水分wによる水蒸気ガス量
$$V’_{(3)}= \frac{22.4}{18} w$$
$$= \frac{22.4}{18}\times0 = 0 Nm3/kg$$
- 燃焼空気に含まれる水分
$$V’_{(4)}= λaZ’Vao’$$
$$Z’= \frac{ΦP_s}{P-ΦP_s}$$
ここで Φ:相対湿度 P:大気圧=101.3kpa
Ps:大気温度(25℃)における飽和蒸気圧=3.17kPa
$$Z’= \frac{0.4\times3.17}{101.3-0.4\times3.17} =0.0127$$
$$V’_{(4)}= λaZ’Vao’= 1.2\times0.0127\times10.6 =0.162 Nm3/kg$$
以上より
単位燃料当たりの湿り燃焼ガス量V’[Nm3/kg-fuel]は
$$V‘=2.82+10.49+0+0.162=13.5 Nm3/kg$$
となります。



